自然杀伤细胞(NK细胞)是机体天然免疫的主要细胞,在识别靶细胞上具有非特异性,通过与靶细胞表面的细胞间黏附分子-1(ICAM-1)的作用参与NK细胞的识别过程。自然杀伤(NK)细胞属于先天淋巴样细胞家族,其鉴定特征为不表达TCR和CD3分子,但表达神经细胞黏附分子(CD56)。这类细胞广泛分布于人类外周血、骨髓及多种组织中。此外,NK细胞还可通过表达自然细胞毒性受体1(NCR1,也称为NKp46或CD335)来鉴定,该受体与NK细胞的功能和激活密切相关[1]。
NK细胞的作用机制
NK细胞作为先天淋巴细胞,能够快速识别并杀伤肿瘤细胞和病毒感染的细胞,主要通过以下途径清除肿瘤:
颗粒胞吐作用:释放含有穿孔素和颗粒酶的颗粒,诱导肿瘤细胞凋亡。颗粒酶进入靶细胞并触发凋亡,而穿孔素在细胞膜上形成孔洞。
死亡受体介导的凋亡:分泌肿瘤坏死因子(TNF)家族成员(如FasL和TRAIL),与靶细胞上的受体结合并触发凋亡。
细胞因子和趋化因子的分泌:通过释放抗癌效应分子(如IFN-γ)诱导肿瘤细胞死亡。细胞因子如IL-2、IL-12、IL-15和IL-18可增强NK细胞的抗肿瘤效果。
抗体依赖性细胞介导的细胞毒性(ADCC):NK细胞表达Fc受体(CD16),可与抗体的Fc区结合。CD16与免疫球蛋白包被的细胞结合后触发信号级联,导致抗体包被的细胞被杀伤[2]。
NK细胞的来源
由于NK细胞具有天然的肿瘤杀伤能力,且来源多样、移植物抗宿主病(GVHD)风险较低,近年来已成为癌症治疗的重要工具。NK细胞的主要来源包括外周血单核细胞(PBMCs)、脐带血(UCB)、诱导多能干细胞(iPSCs)体外分化[3]以及细胞系获得。
▶外周血NK细胞(PB-NK)
NK细胞可以相对容易地从患者(自体PB-NK)或健康供体(异体PB-NK)中分离出来,大多数临床前CAR-NK研究使用的是健康供体的PB-NK。自体NK细胞通常效果较差,原因是其功能可能被自身MHC抗原抑制,或由于患者疾病状态或前期治疗(如高强度化疗和放疗)导致淋巴细胞(包括NK细胞)的质量和数量受损,从而限制自体疗法的成功率。因此,异体PB-NK细胞通常是更优的选择。然而,由于外周血中NK细胞数量较少,需要大规模扩增才能满足治疗需求。虽然PB-NK细胞是成熟的细胞,无需长期分化过程,但它们仍面临转导效率低以及在长期培养中可能耗竭的问题[4-6]。
▶脐带血来源的NK细胞(CB-NK)
PB-NK细胞依赖供体来源,尤其是自体PB-NK,在紧急情况下可能受限,而脐带血(CB)NK细胞则具有现成可用和高产量的优势。例如,一小部分脐带血单位可在两周内扩增出超过10亿个NK细胞。此外,脐带血的单倍型可在采集时确定,从而能够建立HLA不匹配的细胞库。虽然CB-NK细胞某些细胞毒性受体的表达可能低于其他NK细胞,但它们在临床试验中仍显示出良好的前景,尤其是有研究表明,CB-NK细胞在体内具有长期存续的能力[7-10]。
▶干细胞来源的NK细胞(iNK)
利用人类诱导多能干细胞(iPSC)等干细胞分化NK细胞,可提供标准化、货架型的产品,减少供体间的变异性。尽管从干细胞制备NK细胞需要3-5周时间,比其他方法更长,但它能提供更一致的产品。iPSC来源的NK细胞已显示出抗肿瘤活性,并可用于生成CAR-NK细胞。然而,人们仍对其潜在的恶性转化风险、免疫原性以及细胞增殖对细胞因子的依赖性存在担忧[11-12]。
▶NK细胞系:NK-92
NK-92等NK细胞系简化了获取大量NK细胞的过程,因为它们易于培养和扩增。NK-92细胞源自淋巴瘤,具有强大的抗肿瘤活性,并能进行基因改造。然而,它们是肿瘤来源且非整倍体,因此在输注前需进行辐照以防止体内增殖,这限制了它们的持久性。临床试验表明,NK-92细胞安全且有效,但与原代NK细胞相比,其无法在体内增殖可能影响长期疗效[13]。欧洲等临床指导法规,仍对其使用作出了限制。
临床级别NK细胞扩增方法
临床级别NK细胞制备通常包括如下环节:细胞获取(分离/分化/复苏)、细胞大规模扩增、细胞洗涤、制剂分装、冻存/运输等[14]。
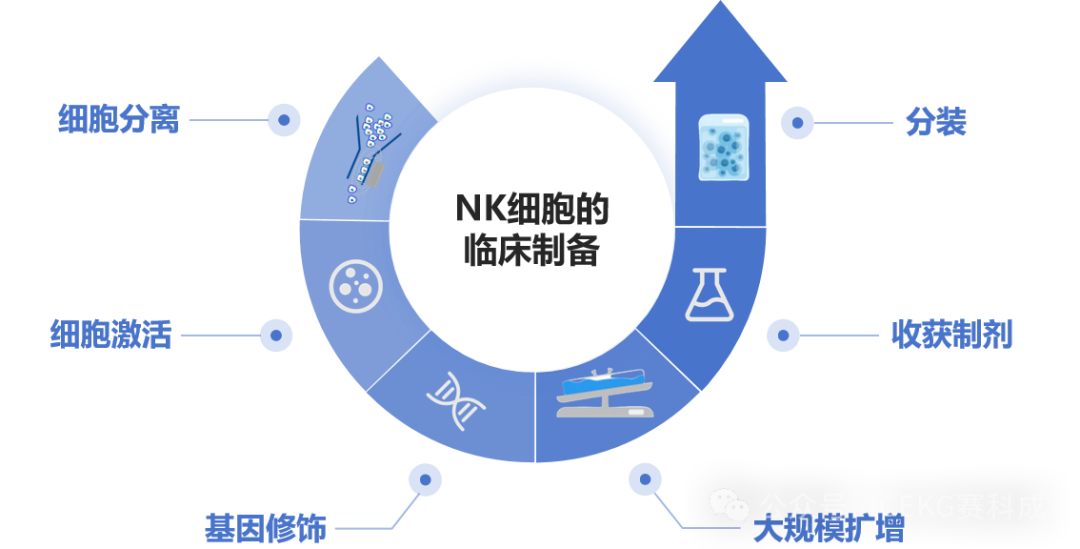
为达到临床所需的NK细胞数量,需要对NK细胞进行体外扩增以达到回输剂量,目前常用生物反应器对细胞进行体外扩增。NK细胞的体外扩增技术包含以下几个方面:
▶NK细胞的激活
细胞因子:常用IL-2、IL-12、IL-15、IL-18等单独或组合激活NK细胞,短期激活虽不显著增加细胞数量,但能增强细胞毒性。
细胞裂解物:如CTV-1裂解物(CNDO-109)可短期激活NK细胞,临床试验中显示安全性。
▶NK细胞的扩增技术
滋养层细胞(Feeder Cells):如基因改造的K562细胞系(表达mbIL-15/41BBL或mbIL-21/41BBL),可大幅扩增NK细胞,是目前临床最常用的方法。
无滋养层细胞:如血浆膜颗粒(PM particles)和抗体刺激(如抗CD3/CD52),提高了安全性和可扩展性。
其他平台:EBV-LCL细胞或自体PBMCs作为滋养层细胞,扩增效果显著但技术复杂度较高。
▶扩增设备
NK细胞可以在透气袋、细胞瓶或生物反应器中进行增殖。而根据各国监管部门的要求,临床级别的NK细胞制备需要满足符合GMP标准、全封闭、一次性耗材、生产记录可溯源等要求。
摆床生物反应器作为一种使用方便、工艺灵活且经济高效的生产方式,广泛应用于多个领域。其基于波浪式摇摆运动的培养袋设计,结合全自动系统监测和控制关键参数(如pO₂和pH)PID控制系统,在经过辐照的一次性细胞培养袋中进行细胞的批次、流加或灌流培养,减少了清洁验证的工作,显著降低了cGMP操作的成本,从而广泛应用于细胞治疗行业。相对于其他培养方式,摆床生物反应器在封闭性、规模化、工艺灵活性、自动化方面都具有显著优势。

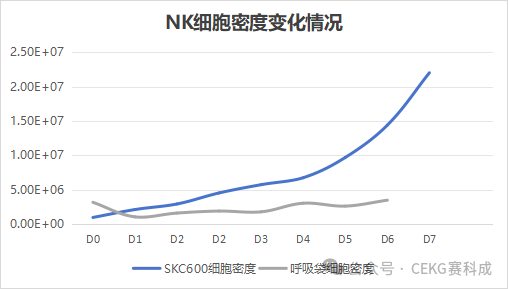
摆床反应器进行细胞扩增案例
在带有10L托盘的SKC600摆床反应器上,配合2L一次性截留膜细胞培养袋进行培养。培养中使用到压缩空气、O2和CO2三路气体。本次培养以K562为滋养层细胞,接种密度为1×106 cells/mL,初始体积为1L,采用pH/DO模式进行培养,对pH和DO采取自动PID控制。
Day 1开启灌流。培养过程中转速为4-9rpm,摇摆角度为3-6°。每天根据细胞状态调整转速和角度。通过鲁尔注射器对上清进行取样,在血糖仪上分析葡萄糖浓度。糖耗越大,则表明细胞生长速率越大。根据所测定糖耗值决定灌流速度。培养至day 8,细胞密度到达2×107 cells/mL,停止灌流,下袋收获。
NK细胞大规模扩增中面临的挑战
在NK细胞生产或大规模扩增中,会面临以下问题:
▶细胞来源
原代NK细胞的获取和扩增:从外周血(PB)或脐带血(CB)中获取的原代NK细胞,其增殖能力可能较低,且存活时间较短,难以满足大规模生产的需要。而CB来源的NK细胞虽然增殖能力较强,但它们在表型和功能上较为幼稚,可能不如其他来源的NK细胞具有细胞毒性[14]。
iPSC来源NK细胞的分化和培养:虽然iPSC可以提供无限的NK细胞来源,但其分化为NK细胞的过程复杂且耗时,增加了生产成本和时间。此外,iPSC在长期培养过程中存在基因突变的风险,可能存在致癌风险,需要进行严格的基因检测和质量控制。
NK细胞系的使用限制:NK细胞系如NK-92等虽然易于基因修饰和扩增,但需要在输注前进行辐射处理,这可能会影响细胞的存活和细胞毒性。此外,NK细胞系在体内的持续性较差,通常在初次输注后两天内就会被清除,可能要面临需要多次回输[15,16]。
▶基因修饰
病毒载体的局限性:目前,NK细胞的基因导入主要依赖于慢病毒载体和逆转录病毒载体,然而,由于NK细胞固有的抗病毒活性,传统慢病毒在NK细胞层面的转导效率并不理想。此外,病毒载体的生产成本高、耗时长,且对于较大的CAR构建(如第三代、第四代和第五代CAR)的核酸携带能力有限。
非病毒基因修饰方法的效率和安全性:非病毒基因修饰方法如转座子系统和CRISPR技术虽然具有潜力,但目前还存在一些问题。转座子系统存在插入突变和免疫原性的风险,而CRISPR技术存在“脱靶”效应,可能导致不必要的突变。此外,非病毒基因修饰方法的转染效率通常低于病毒载体,需要进一步优化以提高效率和安全性[17]。
▶制备过程中的挑战
质量控制:大规模扩增NK细胞需要高效的扩增方法和严格的质量控制。目前,基于滋养层细胞的扩增方法虽然能够快速扩增NK细胞,但存在安全性和监管问题,如滋养层细胞残留的风险。而无滋养层细胞的扩增方法虽然避免了这些问题,但扩增效率较低。此外,NK细胞在扩增过程中可能会发生表型和功能的变化,需要进行严格的质量控制以确保细胞的活性和细胞毒性。其他如人工抗原提呈细胞(aAPCs)等方法的持续研究,也在推动NK细胞疗法进入临床实践起到作用。
细胞保存和运输:NK细胞在保存和运输过程中可能会受到损伤,影响其活性和细胞毒性。例如,冷冻保存可能会导致NK细胞的凋亡和功能下降,需要采取措施如添加保护剂或优化冷冻保存条件来减少损伤。此外,NK细胞的运输也需要在适当的条件下进行,以确保细胞的活性和稳定性[16]。
未来发展方向
NK细胞疗法的未来发展方向聚焦几个方向:
▶联合疗法优化
通过协同CAR-T细胞的特异性与NK细胞的天然细胞毒性,或联合单抗增强ADCC效应,可突破单一疗法局限。化疗药物可协同改善肿瘤微环境,提升NK细胞识别效率。
▶基因工程突破
CAR-NK凭借其HLA非依赖性特征,显著降低GVHD风险。CAR分子结构的升级以及递送难题的解决,有助于推动CAR-NK细胞的产业化。另外iPSC技术的进一步成熟,也将推动“现货型”CAR-NK产品开发,实现标准化大规模生产。
▶无滋养层技术革新
新型人工基质替代传统滋养细胞,通过稳定表达膜结合细胞因子,在确保扩增效率的同时消除残留风险,为GMP标准化生产提供解决方案。
参考文献
[1] Campbell KS, Hasegawa J. NK cell biology: An update and future directions. J Allergy Clin Immunol. (2013) 132:536–44. doi: 10.1016/j.jaci.2013.07.006
[2] 38. Sordo-Bahamonde C, Lorenzo-Herrero S, Payer AR, Gonzalez S, Lopez-Soto A. Mechanisms of apoptosis resistance to NK cell-mediated cytotoxicity in cancer. Int J Mol Sci. (2020) 21:3726. doi: 10.3390/ijms21103726
[3] Sarvaria A, Jawdat D, Madrigal JA, Saudemont A. Umbilical Cord Blood Natural Killer Cells, Their Characteristics, and Potential Clinical Applications. Front Immunol. 2017;8:329
[4] 5. Denman CJ, Senyukov VV, Somanchi SS, Phatarpekar PV, Kopp LM, Johnson JL, et al. Membrane-bound IL-21 promotes sustained ex vivo proliferation of human natural killer cells. PloS One. (2012) 7:e30264. doi: 10.1371/journal.pone.0030264
[5] Fujisaki H, Kakuda H, Imai C, Mullighan CG, Campana D. Replicative potential of human natural killer cells. Br J Haematol. (2009) 145:606–13. doi: 10.1111/j.1365- 2141.2009.07667.x
[6] Lapteva N, Durett AG, Sun J, Rollins LA, Huye LL, Fang J, et al. Large scale ex-vivo expansion and characterization of natural killer cells for clinical applications. Cytotherapy. (2012) 14:1131–43. doi: 10.3109/14653249.2012.700767
[7] Voshol H, Dullens HF, Den Otter W, Vliegenthart JF. Human natural killer cells: a convenient purification procedure and the influence of cryopreservation on cytotoxic activity. J Immunol Methods. (1993) 165:21–30. doi: 10.1016/0022-1759(93)90102-d
[8] Fujiwara S, Akiyama M, Yamakido M, Seyama T, Kobuke K, Hakoda M, et al. Cryopreservation of human lymphocytes for assessment of lymphocyte subsets and natural killer cytotoxicity. J Immunol Methods. (1986) 90:265–73. doi: 10.1016/0022- 1759(86)90084-0
[9] Shah N, Martin-Antonio B, Yang H, Ku S, Lee DA, Cooper LJ, et al. Antigen presenting cell- mediated expansion of human umbilical cord blood yields log-scale expansion of natural killer cells with anti-myeloma activity. PloS One. (2013) 8:e76781. doi: 10.1371/journal.pone.0076781
[10] Liu E, Tong Y, Dotti G, Shaim H, Savoldo B, Mukherjee M, et al. Cord blood NK cells engineered to express IL-15 and a CD19-targeted CAR show long-term persistence and potent antitumor activity. Leukemia. (2018) 32:520–31. doi: 10.1038/leu.2017.226
[11] Woll PS, Martin CH, Miller JS, Kaufman DS. Human embryonic stem cell derived NK cells acquire functional receptors and cytolytic activity. J Immunol.(2005)175:5095–103. doi: 10.4049/ jimmunol. 175.8.5095
[12] Knorr DA, Ni Z, Hermanson D, Hexum MK, Bendzick L, Cooper LJ, et al. Clinical-scale derivation of natural killer cells from human pluripotent stem cells for cancer therapy. Stem Cells Transl Med. (2013) 2:274–83. doi: 10.5966/sctm.2012-0084
[13] Lamers-Kok N, Panella D, Georgoudaki AM, Liu H, Özkazanc D, Kučerová L, Duru AD, Spanholtz J, Raimo M. Natural killer cells in clinical development as non-engineered, engineered, and combination therapies. J Hematol Oncol. 2022 Nov 8;15(1):164. doi: 10.1186/s13045-022-01382-5. PMID: 36348457; PMCID: PMC9644572.
[14] Balkhi S, Zuccolotto G, Di Spirito A, Rosato A, Mortara L. CAR-NK cell therapy: promise and challenges in solid tumors. Front Immunol. 2025 Apr 7;16:1574742. doi: 10.3389/fimmu.2025.1574742. PMID: 40260240; PMCID: PMC12009813.
[15] Fernandez A, Navarro-Zapata A, Escudero A, Matamala N, Ruz-Caracuel B,Mirones I, et al. Optimizing the procedure to manufacture clinical-grade NK cells for adoptive immunotherapy. Cancers (Basel). (2021) 13:577. doi: 10.3390/cancers1303057
[16] Maia A, Tarannum M, Lerias JR, Piccinelli S, Borrego LM, Maeurer M, et al. Building a better defense: expanding and improving natural killer cells for adoptive cell therapy. Cells. (2024) 13:451. doi: 10.3390/cells13050451
[17] McErlean, E.M., McCarthy, H.O. Non-viral approaches in CAR-NK cell engineering: connecting natural killer cell biology and gene delivery. J Nanobiotechnol 22, 552 (2024). https://doi.org/10.1186/s12951-024-02746-4
如果您有更多需求,点击按钮,提交信息,我们会第一时间给您回复。
If you have more requirements, click the button to submit information, and we will reply to you as soon as possible.
版权所有 © 2025 All Rights Reserved. 武汉赛科成科技有限公司 鄂ICP备19012202号-1 网站地图 XML 网站建设:烽虎网络